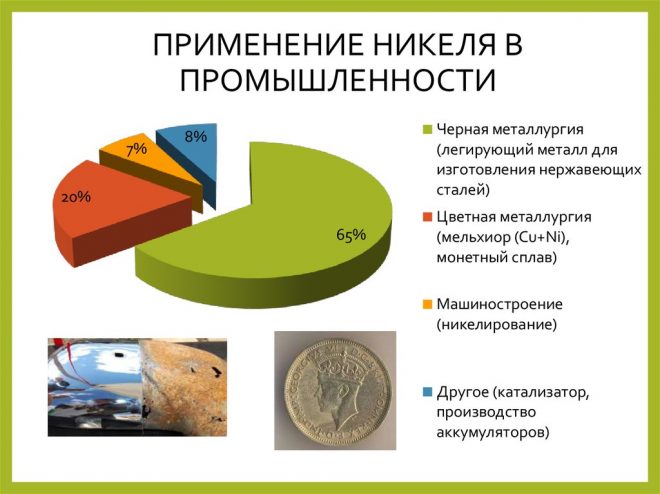
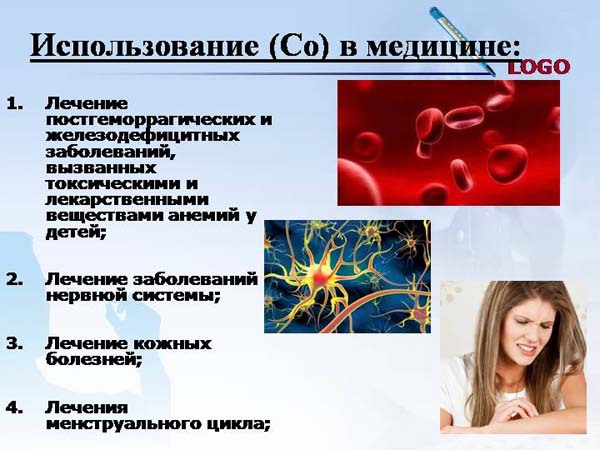
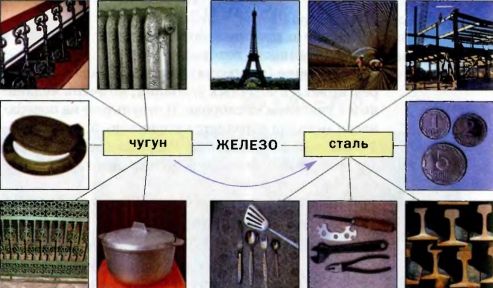
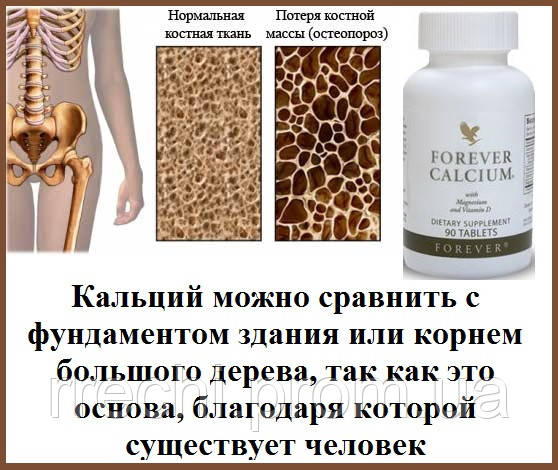
Медь (Cu от лат. Cuprum) — элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) периодической системы химических элементов Д. И. Менделеева, с атомным номером 29.
Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком.
Медь — один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк. Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком.
Латинское название меди Cuprum (древнелат. aes cuprium, aes cyprium) произошло от названия острова Кипр, где было богатое месторождение.

Медь обозначалась алхимическим символом «♀» — «зеркало Венеры», и иногда сама медь именовалась алхимиками тоже как «венера». Это связано с тем, что богиня красоты Венера (Афродита), являлась богиней Кипра, и из меди делались зеркала. На Среднем Урале, — связан известный персонаж сказов П. П. Бажова — Хозяйка медной горы, покровительница добычи малахита и меди. По одной из гипотез, она является преломлённым народным сознанием образом богини Венеры.
Медь встречается в природе как в соединениях, так и в самородном виде.

Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2.
Медь — особый
Металл.
Ток проводит
На ура.
Красный цвет,
Металла блеск.
Соединение —
Голубое.
Розово-он-золотой.
Найдешь его ты у себя.
Он в проводах,
Монетках,
А в организме
Помогает
Пищу переварить.
Довольно слабый
Сим металл.
В кислотах
Он пассивен.
И только серная
Азотная
Способны
Принять его.
Он не элита.
Он обычен.
Но он полезен
Для всех нас.
И только серебро
Проводит
Электроток
Лучше его.
И металлический водород.
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.

В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях и комплексах можно получить соединения со степенью окисления +3, +4 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.

Если б мы смогли кататься
На машине времени,
То смогли бы оказаться
В первобытном племени
И узнали б, как из Меди
Украшения для леди,
Даже кубики для детки
Получали раньше предки.
Медный молоток и ножик,
Медный меч нашли бы тоже.
Все из Меди человек
Делал в древний медный век!
Медь широко применяется в электротехнике для изготовления силовых и других кабелей, проводов или других проводников, например, при печатном монтаже.
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
В связи с высокой механической прочностью и пригодностью для механической обработки медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах.
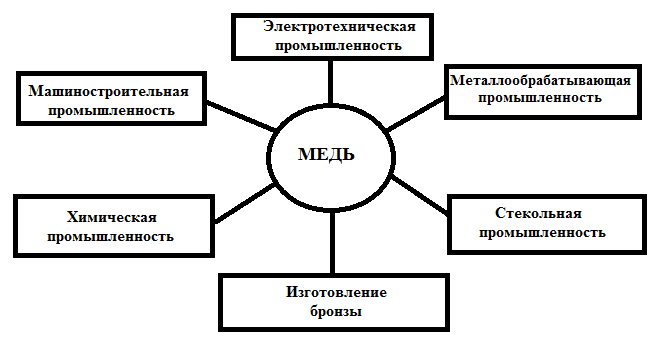
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь.

Медь освоил человек
В стародавний «медный век».
Позже стали делать сплавы.
И пошла по миру слава.
Сплавы — бронза, мельхиор
Всем известны с давних пор.
Украшения, посуду
Мы из них встречаем всюду.
Был у меди шаг победный!
Нынче провод — чаще медный,
Медь во многих есть предметах —
Трубах, кровле и монетах.
Медь — устойчивый металл,
Потому и нужным стал.
ВераНиКа
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.

Заставили меня вы покраснеть,
Но я не золото, я — медь.
По цвету я на золото похожа,
Тягучая и вязкая. И что же?
Хороший тепло- и электропроводник
Об этом знает каждый ученик.
Не замечаю я разбавленных кислот,
Зато предпочитаю кислород.
При нагревании я с ним даю оксид,
Который окисляет альдегид.
Прошу вас всех учесть момент:
Я важный биоэлемент.
К моллюскам я храню любовь
И синей делаю их кровь.
Со мною их пигмент несет
По клеткам тела кислород.